La thérapie cellulaire utilisant des cellules encapsulées dans des matrices injectables est une technique prometteuse pour le traitement minimalement invasif de la dégénérescence du disque intervertébral, qui représente l’une des causes majeures des maux de dos dont souffre 19 % de la population mondiale. Toutefois, cette approche thérapeutique est limitée par les propriétés mécaniques généralement faibles des matrices injectables. L’étude actuelle démontre le potentiel de nouvelles formulations d’hydrogels de chitosane thermosensibles ayant d’intéressantes propriétés mécaniques pour la régénération du disque intervertébral, notamment sa partie centrale appelée le noyau pulpeux (NP).
Introduction
La dégénérescence du disque intervertébral (DIV) est l’une des causes importantes des maux dans le bas du dos [1] dont souffre 19 % de la population mondiale [2]. Les techniques actuelles de prise en charge de ce dysfonctionnement sont non seulement très invasives, mais aussi inefficaces pour la restauration complète des fonctions biomécaniques du DIV. L’élaboration de nouvelles techniques minimalement invasives, axées sur la réparation ou la restauration du DIV, devient donc pertinente. L’une des techniques prometteuses pour cette application est la thérapie cellulaire. Cette technique consiste à injecter des cellules et des molécules particulières, éventuellement encapsulées dans des matrices biocompatibles, dans l’objectif de régénérer le disque, notamment sa partie centrale : le noyau pulpeux (NP). Toutefois, cette application est limitée par les propriétés mécaniques généralement très faibles des matrices injectables étudiées jusqu’à présent [3, 4].
Notre équipe a récemment mis au point des hydrogels de chitosane injectables ayant de meilleures propriétés mécaniques et une meilleure cytocompatibilité [5]. Ces formulations, liquides à température pièce, mais se gélifiant à 37 °C, pourraient être optimisées pour la régénérescence du DIV. L’objectif formel de ce travail est d’étudier ces formulations et de déterminer celles présentant un potentiel pour le support mécanique du NP humain, tout en permettant la survie des cellules NP encapsulées et la synthèse d’un tissu de composition similaire à celui du NP natif.
Matériel et méthodes
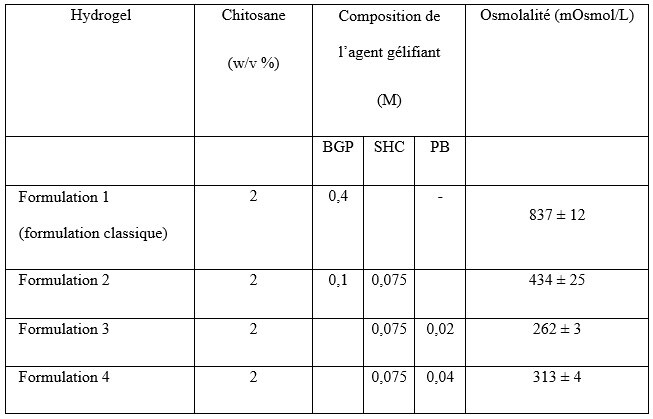
Les hydrogels ont été préparés en mélangeant une solution acide de chitosane et des solutions d’agents gélifiantsSolution servant à induire la gélification constituées de sodium hydrogénocarbonate (SHC), de tampon phosphate (PB) et/ou de β-glycérophosphate (BGP). La composition des quatre formulations testées est présentée dans le tableau 1.
Tableau 1 Composition des formulations d’hydrogel de chitosane et leur osmolalité
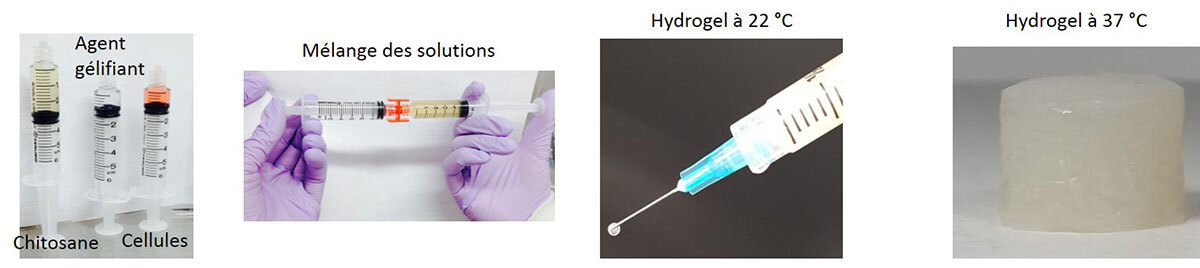
Des tests rhéologiques avec un rhéomètre rotationnel (Anton Paar) à la température pièce (22 °C) et à la température du corps (37 °C) ont été effectués afin de tester respectivement la stabilité des formulations à 22 °C et le profil de gélification à 37 °C. Les tests mécaniques en compression non confinée sur des hydrogels incubés pendant 24 h à 37 °C ont été effectués afin de déterminer le module de Young sécantParamètre mécanique permettant de caractériser la rigidité d’un matériau de chaque échantillon. Ces propriétés mécaniques ont été comparées à celles du NP humain en compression non confinée grâce à un test de relaxation de contrainte incrémentale [6].
L’osmolarité de ces hydrogels a également été mesurée. Ensuite, des cellules de NP bovines ont été encapsulées dans ces hydrogels et cultivées pendant quatorze jours à 37 °C. Des tests de viabilité par AlamarBlue® et LIVE/DEAD® ont été faits afin d’évaluer respectivement l’activité métabolique des cellules encapsulées et leur taux de viabilité. L’activité de synthèse de ces cellules a également été évaluée en mesurant la quantité de glycosaminoglycanes (GAG) produite par le test du 1-dymethylmethylène (DMMB). L’injectabilité de ces hydrogels a été testée dans des disques humains explantés grâce à des aiguilles de jauge 25.
Résultats
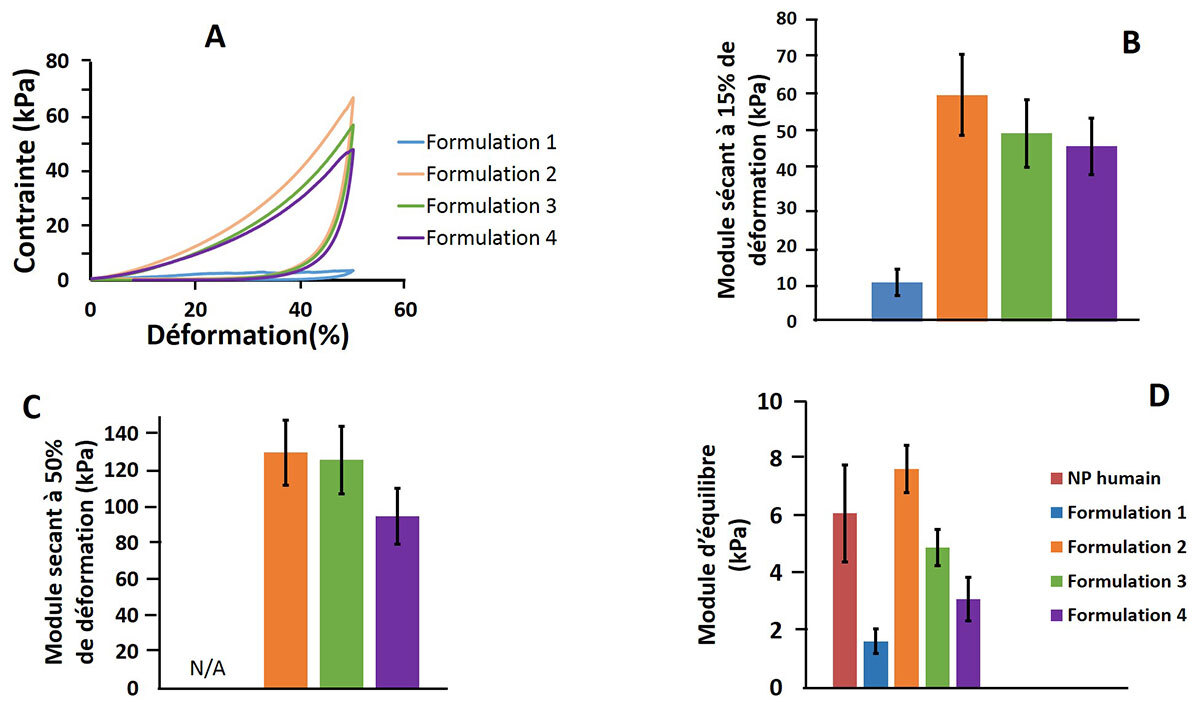
Toutes les formulations d’hydrogels, sauf la formulation classique (1), présentent un module de stockage G’ faible et stable à 22 °C. Ce module évolue rapidement à 37 °C, confirmant la thermosensibilité de ces matériaux. Les nouvelles formulations d’hydrogel présentent des propriétés mécaniques en compression plus élevées que la formulation classique (figure 2 A, B, C). Les tests en relaxation de contrainte montrent que deux de ces nouvelles formulations (2 et 3) présentent des propriétés mécaniques similaires aux propriétés du NP humain (figure 2 D).
En ce qui concerne les résultats de biocompatibilité, la formulation classique (la 1) est hypertonique avec une osmolalité > 800 mosmol/kg tandis que toutes les autres formulations présentent des valeurs d’osmolalité proches des valeurs physiologiques de l’intérieur du disque (430 mOsmol/kg)[7]. Un taux de viabilité d’environ 85 % des cellules encapsulées a été observé, les plus hautes activités métaboliques étant après 14 jours de culture pour les formulations 2 et 3 (Figure 3). Par contre, c’est la formulation 2 qui présente la production la plus élevée de glycosaminoglycanes (GAG) (figure 4).
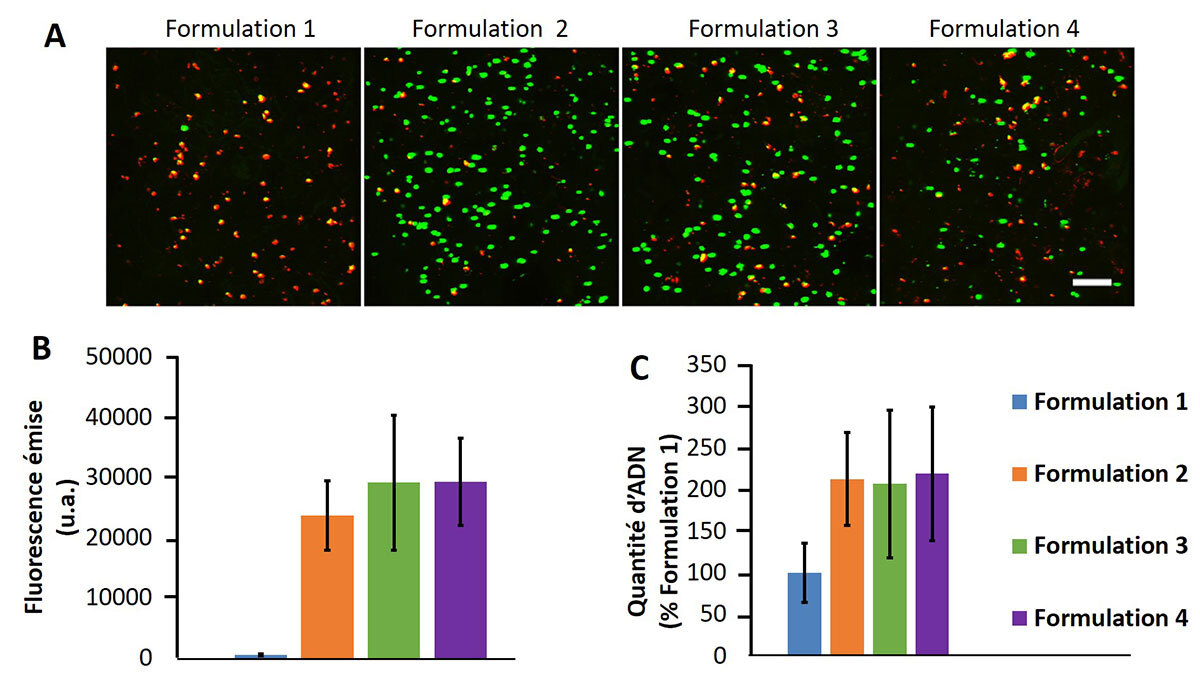
Tableau 2 Production de GAG selon la formulation
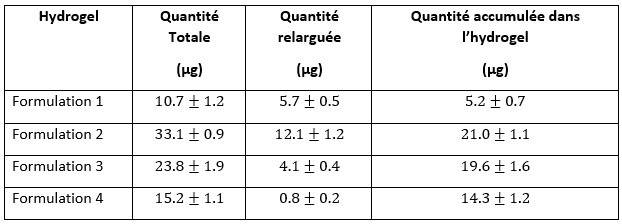
Pour finir, les tests d’injectabilité dans des disques humains explantés montrent une bonne rétention de la formulation 3. Non seulement la viscosité initiale de ce gel permet l’injection par une aiguille de petit diamètre en plus de combler les défauts présents dans le disque, mais aussi une gélification assez rapide pour éviter les fuites hors du site d’injection (figure 4).
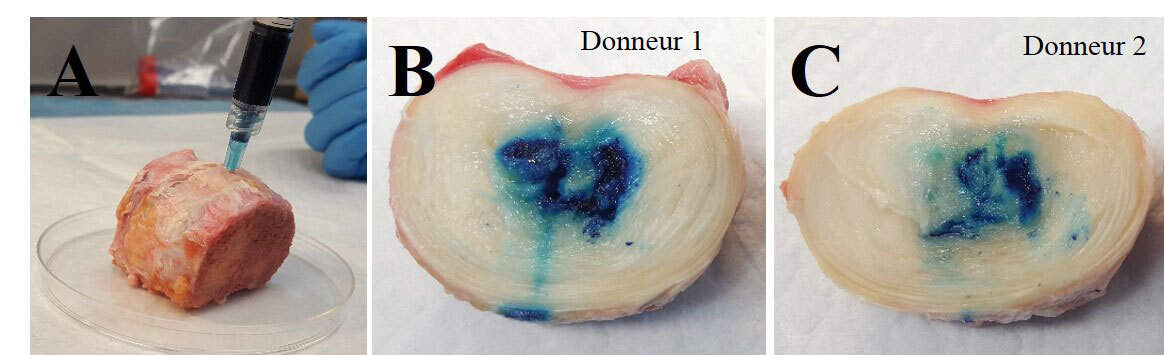
Conclusion
Cette étude permet de conclure que la formulation 2 est une matrice injectable prometteuse pour la réparation des disques intervertébraux parce qu’elle présente des propriétés mécaniques similaires au NP humain et un environnement adéquat pour la survie des cellules ainsi que la synthèse et la rétention de glycosaminoglycanes, un des composants importants du tissu NP. La suite du projet se concentrera sur l’étude des bénéfices de l’ajout d’une molécule bioactive sur l’activité de synthèse des cellules et donc la capacité régénérative de la technologie. À terme, ce projet permettra de mettre au point des hydrogels injectables combinant cellules et agents bioactifs pour la médecine régénératrice notamment pour la régénérescence des disques intervertébraux.
Information supplémentaire
Pour plus de détails sur cette recherche, consulter l’article suivant :
Alinejad, Yasaman, Atma Adoungotchodo, Michael P Grant, Laura M Epure, John Antoniou, Fackson Mwale et Sophie Lerouge. 2018. « Injectable Chitosan Hydrogels with Enhanced Mechanical Properties for Nucleus Pulposus Regeneration ». Tissue Engineering Part A. doi: 10.1089/ten.tea.2018.0170



