Une nouvelle thérapie injectable prometteuse contre les maux de dos
Achetée sur Istockphoto.com.
Les thérapies injectables constituent une approche minimalement invasive pour le traitement de la dégénérescence du disque intervertébral. Ces techniques nécessitent l’utilisation d’une matrice injectable qui servira à la fois à renforcer mécaniquement le tissu dégénéré et fournir aux cellules encapsulées un support tridimensionnel indispensable à la production des constituants requis pour la restauration des propriétés biomécaniques du tissu. Notre équipe a récemment mis au point un hydrogel de chitosane injectable possédant les propriétés adaptées pour cette application. La présente étude a pour objectif d’évaluer le bénéfice de l’ajout de la gélatine et du Link- N, deux molécules connues pour améliorer l’activité des cellules du disque, ceci dans l’objectif d’accélérer le processus de régénération du disque.
La dégénérescence du disque intervertébral
Les maux de dos constituent un important problème de santé publique, qui affecte jusqu’à 80 % de la population mondiale au moins une fois dans leur vie. La dégénérescence du disque intervertébralStructure cartilagineuse située entre les vertèbres (DDIV) est l’une des causes principales de ce dysfonctionnement [1]. Actuellement les seules options lorsque la médication ne fait plus effet, sont des techniques chirurgicales très invasives et peu efficaces. C’est pourquoi de nombreuses recherches sont en cours pour mettre en place des thérapies injectables pouvant stimuler la réparation naturelle du disque. Ces thérapies injectables nécessitent généralement une matrice injectable, des cellules et des agents bioactifs pour stimuler les cellules.
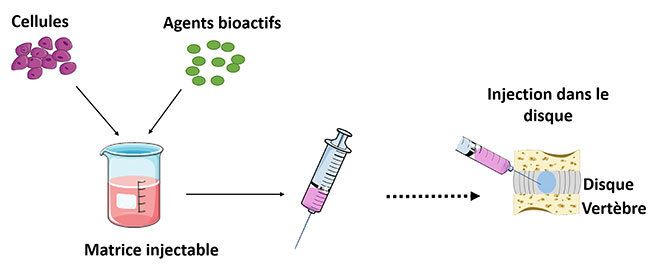
Figure 1: Constituants requis pour une thérapie injectable de réparation du disque intervertébral
La matrice injectable, dans ce cas précis, permet à la fois de renforcer mécaniquement le tissu dégénéré, mais fournit également un environnement tridimensionnel pour la survie et l’activité des cellules. Pour ce faire, elle doit respecter un cahier de charges précis qui requiert entre autres un comportement mécanique similaire au tissu natif et une biocompatibilité adéquate.
Stratégies pour augmenter la production de glycosaminoglycanes
Les travaux antérieurs nous ont permis de mettre au point une matrice injectable qui respecte ces spécifications [2]. Cette matrice est un hydrogel thermosensible constitué de chitosane et d’agents gélifiants : du β-glycérophosphate (BGP) et du sodium hydrogénocarbonate (SHC). La matrice est liquide à la température ambiante, permettant ainsi l’encapsulation de cellules. Elle gélifie en quelques secondes à la température du corps (37 °C) et présente des propriétés mécaniques similaires à la partie centrale du disque : le noyau pulpeux (NP). Les cellules encapsulées dans cette matrice ont été capables de survivre et de produire les composants du disque nécessaires à sa régénération, notamment les glycosaminoglycanes (GAG), qui jouent un rôle prépondérant dans le maintien des propriétés mécaniques du disque.
Cependant, la quantité de GAG produite par les cellules en quatorze jours de culture était sous-optimale, considérant les quantités observées dans les tissus natifs sains. L’objectif de la présente étude a été donc de développer des stratégies pour améliorer l’activité des cellules encapsulées. Dans cette optique, deux différentes avenues ont été étudiées.
Dans un premier lieu, de la gélatine a été ajoutée à l’hydrogel. La gélatine est connue pour améliorer l’adhésion des cellules, ce qui pourrait augmenter leur activité [3]. Dans un second temps, le Link N, un peptide naturellement présent dans le disque et ayant démontré son efficacité à stimuler les cellules, a été ajouté dans le milieu de culture [4].
Méthodes suivies pour évaluer l’effet de la gélatine et du Link N
Dans un premier temps, l’effet de la gélatine et du Link N a été évalué séparément. D’abord, le gel de chitosane a été préparé en mélangeant une solution de chitosane Poudre de chitosane diluée dans de l'acide acétique ou de chitosane/gélatine avec une solution d’agents gélifiants (SHC et BGP) et une suspension de cellules de NP bovin. L’effet de la gélatine sur l’activité des cellules et les propriétés mécaniques du gel a été évalué.
Ensuite, l’effet du Link N a été évalué en caractérisant la production de GAG par les cellules encapsulées dans le gel de chitosane (sans gélatine) et cultivées dans un milieu normal ou dégénératif. Le milieu normal est un milieu de culture commercialisé qui simule la composition biochimiquepH physiologique, hyperosmolarité d’un disque en santé, tandis que le milieu dégénératif réplique l’environnent d’un disque dégénérépH et osmolarité moins élevés, présence de minéraux et de facteurs inflammatoires, donc un peu agressif pour les cellules.
Dans un second temps, l’effet additif de la gélatine et du Link N a été étudié en encapsulant les cellules dans un hydrogel de chitosane, avec ou sans gélatine, dans un milieu de culture normal ou dégénératif, avec ou sans Link N. Le facteur de croissance transformant βC'est un facteur de croissance ayant démontré son efficacité pour améliorer les capacités des cellules du disque à produire des GAG. (TGF-β) a été utilisé comme contrôle dans cette partie de l’étude (voir figure 2).

Figure 2 : Schéma du test d’encapsulation
Les propriétés mécaniques ont été caractérisées par un test de compression confinée. La production de GAG a été évalué selon la quantité de GAGs sulfatés dans chaque échantillon par le test de diméthyl-méthylène. Les tests de viabilité cellulaire ont été faits par Live/Dead et le contenu en ADN a été mesuré par le PicoGreen.
Composition optimale de la matrice injectable
L’ajout de la gélatine à 1 % augmente significativement la production de GAG sans trop augmenter la viscosité de la solution de gel et donc mettre en péril son injectabilité. Cette concentration assure également une amélioration substantielle des propriétés mécaniques tout en présentant un profil de gélification similaire au gel sans gélatine (voir figure 3).
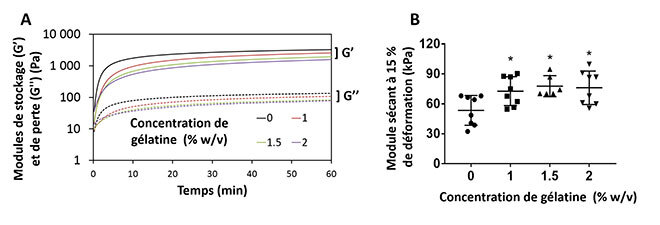
Figure 3: Effet de la gélatine sur les propriétés mécaniques et biologiques du gel de chitosane A) Profil de gélification des gels de chitosane à 37 °C, avec ou sans gélatine. B) Module sécant à 15 % de déformation durant un test de compression non confinée.
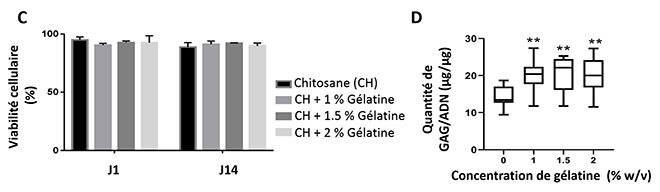
C) Viabilité des cellules bovines encapsulées dans le disque après 1 et 14 jours de culture D) Effet de la gélatine sur la production de GAG par les cellules après 14 jours de culture (*p< 0.05 , ** p < 0.01 comparé au contrôle)
Quant au Link N, il permet d’améliorer la production de GAG dans le milieu dégénératif, mais son effet reste négligeable sur les cellules dans un milieu normal (figure 4), ce qui constitue un résultat intéressant parce que ce sont des disques en dégénérescence qui sont ciblés.
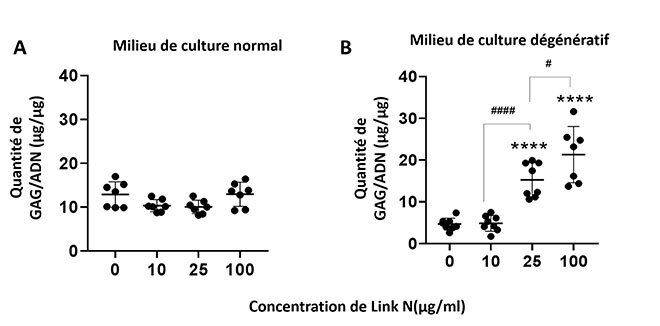
Figure 4: Effet du Link N sur la production de glycosaminoglycanes dans un milieu A) normal ou B) dégénératif (**** p<0.0001 comparé au contrôle)
Ces résultats confirment donc que la gélatine et le Link N, utilisés séparément, ont un effet positif sur la production de GAG et donc sur l’activité de synthèse des cellules encapsulées. Qu’en est-il de leur utilisation simultanée?
L’encapsulation des cellules dans des gels de chitosane avec gélatine et en présence de Link N montre un effet additif sur la production de GAG. En effet, on remarque que la production de GAG en présence de gélatine et de Link N est plus importante que celle de chacun de ces composants pris séparément (figure 5). Il est important de mentionner que les cellules encapsulées dans les gels de chitosane et gélatine en présence de Link N produisent des quantités de GAG similaires à celles observées en présence de TGF-β.
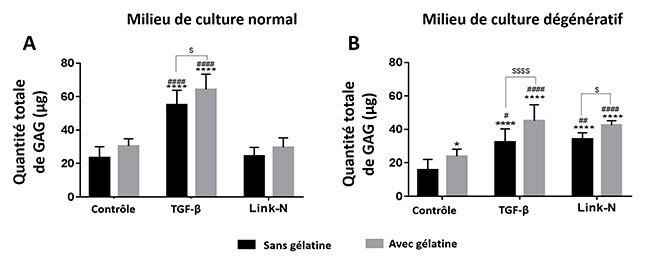
Figure 5: Effet additif du Link N et de la gélatine sur la production de GAG par les cellules encapsulées dans un milieu A) normal ou B) dégénératif (*p<0.05, ****p<0.0001 comparé au contrôle sans gélatine, ###p<0.001, #### p<0.0001 comparé au contrôle avec gélatine, $ p<0.05, $$$ p<0.001, $$$$p<0.0001)
Le Link N et la gélatine constituent donc une solution de rechange intéressante au facteur de croissance, qui est certes efficace pour l’activité des cellules, mais qui comporte aussi des inconvénients possiblement incompatibles avec une utilisation clinique. En effet, le TGF est impliqué dans de nombreux autres mécanismes biologiques et signalisations pro-prolifératives et pourrait faire craindre de provoquer des cancers.
Conclusion
Cette étude a démontré que la gélatine et le Link N permettent d’augmenter significativement la production de GAG de cellules encapsulées dans des gels de chitosane. Bien que d’autres étapes restent à franchir, ces résultats suggèrent que la gélatine et le Link N associés au gel de chitosane constituent une option encourageante pour la régénération du disque intervertébral et donc un traitement prometteur contre les maux de dos.
Informations supplémentaires
Pour plus d’informations sur cette recherche, consultez l’article suivant :
Adoungotchodo A, Epure L, Mwale F, Lerouge S (2021) Chitosan-based hydrogels supplemented with gelatine and Link N enhance extracellular matrix deposition by encapsulated cells in a degenerative intervertebral disc environment. European cells & materials 41: 471-484.



